O Grupo para o avanço no design de nanomateriais (Group for Advancing in Nanomaterials Design) do Instituto de Química da USP (GrAND), coordenado pelo professor Pedro Henrique Cury Camargo, tem como uma de suas principais linhas de pesquisa a utilização de nanomateriais como catalisadores, elementos cuja presença em uma reação química acelera e potencializa o seu andamento, sem que eles próprios sejam reagentes. “Apenas a superfície do material age sobre a reação química”, explica Camargo. “Quanto menor o tamanho do material, maior a razão entre a sua superfície e o seu volume”. Desse modo, a utilização de nanomateriais resulta em grande economia de material usado, uma vantagem tanto ambiental quanto financeira – quando se leva em conta que alguns dos principais catalisadores usados na indústria são metais nobres como ouro, prata e platina.
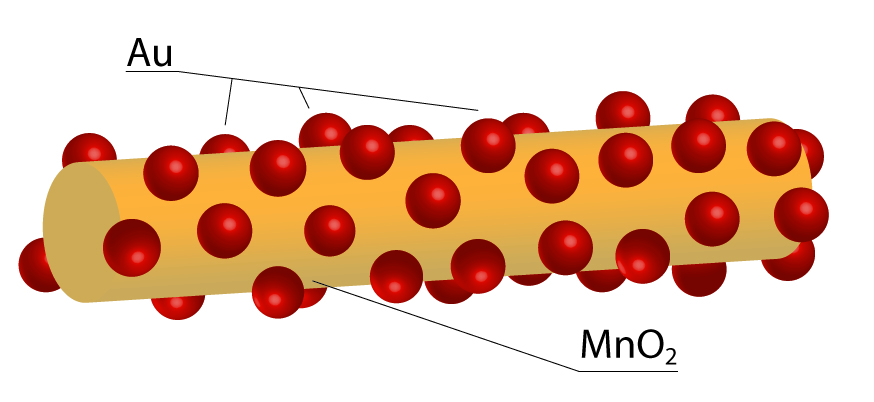
O mais recente trabalho do grupo, publicado esse ano, utilizou o ouro, por ser um material interessante para vários tipos de reação utilizados na indústria, como oxidação, redução e acoplamento. Foram utilizadas partículas com tamanhos entre 1 e 3 nanômetros (unidade um bilhão de vezes menor que o metro), pequenas até para os padrões de nanomateriais, em geral cerca de dez vezes maiores. As partículas de ouro, porém, tenderiam a se aglomerar, reduzindo sua superfície de contato com os reagentes. Para evitar que isso aconteça, a solução encontrada foi dispor as partículas uniformemente em nanofios de dióxido de manganês (MnO2). A presença deles não apenas permite o maior aproveitamento da quantidade de material empregada, mas também facilita sua reutilização em outras reações, uma vez que permitem uma recuperação mais fácil das nanopartículas.
O resultado da experiência comprovou a eficiência da técnica: para um mesmo desempenho da reação, foi necessário utilizar cem vezes menos material do que nas alternativas mais eficientes até então conhecidas, partículas pouco maiores de ouro combinadas com dióxido de silício ou em nanotubos de carbono. A atividade catalítica do material facilita ainda outros aspectos do processo: não há necessidade de uso de solventes potentes – sendo suficiente a água – nem de aquecer os reagentes, bastando a temperatura ambiente para que ocorra a reação. Esses dois diferenciais representam ainda outras vantagens ambientais.
Em suas pesquisas, o grupo também procura outras formas mais econômicas e sustentáveis de suprir essa necessidade da indústria química. Uma delas é a chamada catálise plasmônica, que foi testada na prata: trata-se daquela que usa, como fonte de energia, apenas a luz. A experiência tece sucesso em conseguir reações de oxidação – a luz energiza os elétrons, que se unem ao oxigênio. Foram feitos ainda experimentos com objetos ocos (economizando material) de diferentes formatos – o nanotubo oco liso foi o que demonstrou o melhor resultado. “Não é convencional fazer nanomateriais tão precisos na sua forma”, afirma Camargo. “Temos condições privilegiadas”.
