Uma descoberta recente relacionada à enzima Ohr (proteína de resistência a hidroperóxidos orgânicos, na sigla em inglês), presente em algumas bactérias, especialmente nas patogênicas, pode resultar em novas abordagens terapêuticas, como antibióticos mais eficientes.
O estudo, coordenado por Luis Eduardo Soares Netto, pesquisador e professor do Instituto de Biociências da Universidade de São Paulo, contou com a participação de um grupo de treze pessoas ‒ entre elas, Thiago Alegria, mestre pelo IB, e Diogo Meireles, pós-doutor também pela USP.
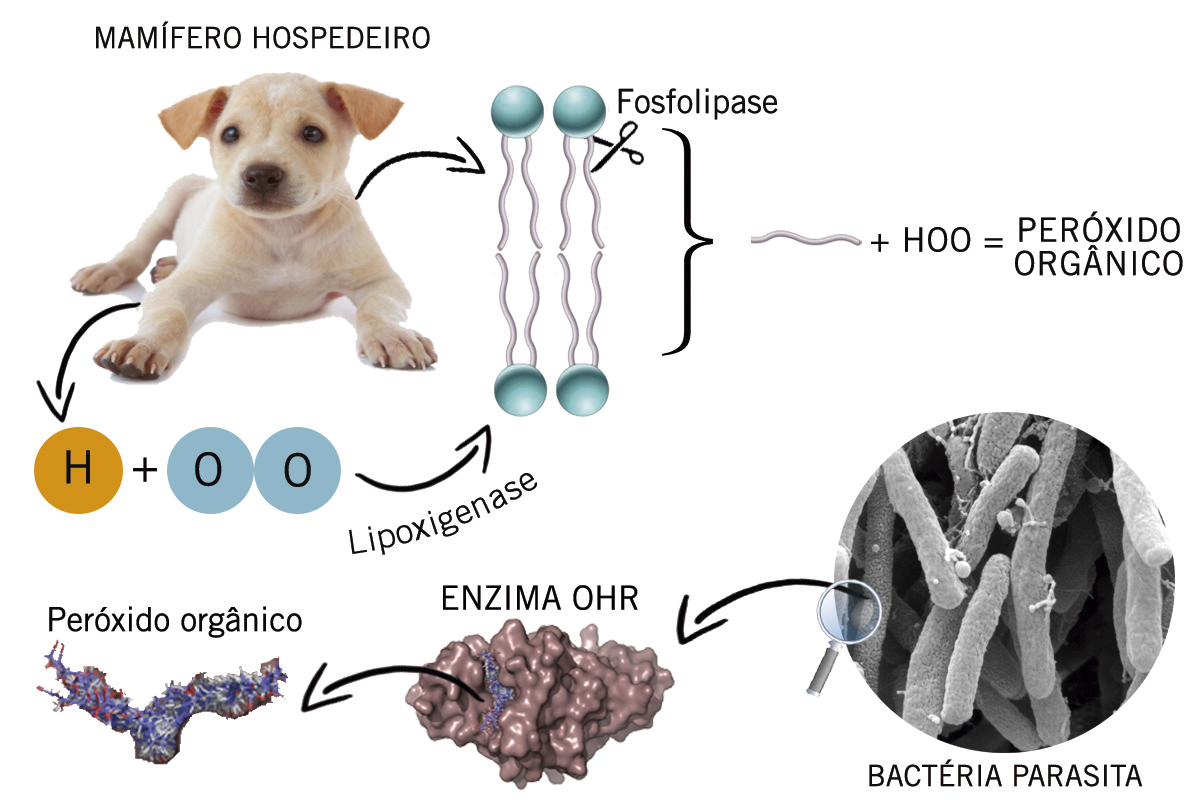
“Enzimas são proteínas que aceleram reações químicas. Quando o parasita entra em contato com o hospedeiro, esse libera substâncias oxidantes como forma de autoproteção. A bactéria, por sua vez, libera antioxidantes para tentar sobreviver à infecção”, explica Netto.
O que acontece é uma reação em cadeia. Para melhor entendimento, o professor recomenda imaginar que a membrana celular é formada por diversos ‘bonequinhos’, os lipídios, com pernas e cabeça. Uma enzima chamada fosfolipase “corta” uma dessas pernas. Outra enzima, a lipoxigenase, agrega o oxigênio do ar com o hidrogênio da célula hospedeira à perna amputada, formando, assim, o hidroperóxido orgânico.
“Nossos estudos acerca da Ohr começaram na Era Genômica, no final dos anos 1990, começo dos 2000. De lá para cá, fomos evoluindo em termos de pesquisa para que pudéssemos entender essa questão como um todo, sua atuação, seu funcionamento, seus impactos e as maneiras de combater sua ação danosa”, afirma Netto. “Nosso trabalho mais recente foi descobrir quais são esses peróxidos. Ou seja, qual era o melhor substrato para que a Ohr pudesse agir”, elucida o pesquisador.
Para que isso ocorresse, Neto conta que o processo foi dividido em três etapas. Na primeira, os cientistas trabalharam com simulação computacional para avaliar a estrutura da proteína. A segunda abordagem foi experimental: produziram a proteína pura, fora do corpo bacteriano, e avaliaram-na por meio de um método conhecido como cinético, o qual consiste em medir a reação da enzima quando submetida a diferentes peróxidos.
Por fim, o grupo foi para o laboratório ver os estudos anteriores na prática. “Pensamos que o melhor substrato seria aquele que, quando exposto ao gene da Ohr, tivesse a maior velocidade de reação”, declara Neto. Com isso, descobriu-se que os ácidos graxos e peróxido de nitrito são os antioxidantes mais relevantes em termos de resistência bacteriana.
O professor revela que as descobertas podem ser muito úteis para a criação de novos medicamentos mais eficazes, uma vez que agora sabe-se exatamente sobre qual substância a enzima tem maior ação. Além disso, não são conhecidas células de plantas ou de animais mamíferos que possuam uma proteína com estrutura semelhante à da Ohr, o que sugere que o fármaco criado especificamente para essas condições infecciosas não prejudicará o organismo hospedeiro.
Os resultados obtidos deram origem ao artigo Ohr plays a central role in bacterial responses against fatty acid hydroperoxides and peroxynitrite, publicado na revista científica Proceedings of the National Academy of Sciences.
“Agora, estamos caminhando para um novo estudo. Pensávamos que a Ohr só estava presente em bactérias, mas foi descoberto que as mitocôndrias dos fungos também possuem a enzima. Ainda não há muitas informações sobre isso, mas é um passo importante para a ciência que cuida do tratamento de doenças”, conclui Netto.
